Kestabilan Unsur dan Pembentukan Ikatan
Kestabilan Unsur
Unsur-unsur kimia cenderung mencapai konfigurasi elektron yang stabil, biasanya menyerupai konfigurasi elektron gas mulia yang memiliki kulit valensi penuh. Kestabilan ini dicapai dengan salah satu dari tiga cara berikut:
- Melepaskan elektron untuk mencapai konfigurasi oktet, umumnya dilakukan oleh logam.
- Menerima elektron untuk mencapai konfigurasi oktet, umumnya dilakukan oleh non-logam.
- Berbagi elektron dengan atom lain untuk mencapai kestabilan, biasanya terjadi dalam ikatan kovalen.
Proses ini berkaitan dengan energi ikatan, di mana atom cenderung berada dalam keadaan energi terendah yang memungkinkan mereka menjadi lebih stabil.
Pembentukan Ikatan Ion
Ikatan ion terbentuk ketika terjadi transfer elektron dari satu atom ke atom lain, yang biasanya melibatkan logam dan non-logam. Dalam ikatan ini, atom yang melepaskan elektron menjadi ion bermuatan positif (kation), sementara atom yang menerima elektron menjadi ion bermuatan negatif (anion).
Contoh Pembentukan Ikatan Ion: Natrium Klorida (NaCl)
Atom natrium (Na), yang memiliki konfigurasi elektron 2,8,1, cenderung melepaskan satu elektron untuk mencapai konfigurasi elektron yang stabil (2,8). Ini membuatnya menjadi ion Na+.
Atom klorin (Cl), yang memiliki konfigurasi elektron 2,8,7, cenderung menerima satu elektron untuk mencapai konfigurasi elektron stabil (2,8,8), menjadi ion Cl−.
Ikatan ion terbentuk ketika ion Na+ dan Cl− saling tarik-menarik, membentuk senyawa NaCl yang netral secara elektrik.
Pembentukan Ikatan Kovalen
Ikatan kovalen terbentuk ketika dua atom berbagi satu atau lebih pasangan elektron. Ini biasanya terjadi antara dua non-logam. Berbeda dengan ikatan ion, dalam ikatan kovalen tidak ada transfer penuh elektron; sebaliknya, pasangan elektron dibagi bersama oleh atom-atom yang terlibat.
Contoh Pembentukan Ikatan Kovalen: Molekul Air (H2O)
Atom oksigen (O) memiliki enam elektron di kulit valensinya dan membutuhkan dua elektron tambahan untuk mencapai konfigurasi oktet yang stabil. Setiap atom hidrogen (H) memiliki satu elektron dan membutuhkan satu elektron lagi untuk mencapai kestabilan.
Dalam molekul air, oksigen berbagi dua pasang elektron, satu dengan setiap atom hidrogen, membentuk dua ikatan kovalen tunggal. Ini membuat molekul H2O stabil.
Contoh Soal dan Pembahasan
Soal 1:
Jelaskan bagaimana ikatan ion terbentuk antara magnesium (Mg) dan oksigen (O). Sertakan konfigurasi elektron dari kedua unsur dan hasil akhirnya.
Pembahasan:
Magnesium (Mg) memiliki konfigurasi elektron 2,8,2. Untuk mencapai konfigurasi oktet yang stabil, Mg akan melepaskan dua elektron, sehingga menjadi ion Mg2+. Oksigen (O) memiliki konfigurasi elektron 2,6 dan membutuhkan dua elektron untuk mencapai oktet, sehingga O akan menerima dua elektron dan menjadi ion O2−. Ikatan ion terbentuk ketika Mg2+ dan O2− saling tarik-menarik, membentuk senyawa magnesium oksida (MgO).
Soal 2:
Gambarkan struktur Lewis dari molekul karbon dioksida (CO2) dan jelaskan jenis ikatan yang terjadi.
Pembahasan:
Karbon (C) memiliki empat elektron di kulit valensinya, sementara oksigen (O) memiliki enam. Dalam molekul CO2, karbon berbagi dua pasang elektron dengan masing-masing atom oksigen, membentuk dua ikatan kovalen rangkap. Struktur Lewis-nya akan menunjukkan karbon di pusat dengan dua garis ganda menuju masing-masing atom oksigen.
Soal 3:
Tentukan struktur Lewis dari ion ammonium (NH4+) dan jelaskan bagaimana ikatan kovalen dikoordinasi terjadi.
Pembahasan:
Dalam ion ammonium, nitrogen (N) memiliki lima elektron valensi dan membentuk tiga ikatan kovalen tunggal dengan tiga atom hidrogen (H). Sisa satu elektron nitrogen digunakan untuk membentuk ikatan kovalen koordinasi dengan atom hidrogen keempat, di mana hidrogen tidak memberikan elektron tetapi menggunakan pasangan elektron bebas dari nitrogen. Akibatnya, ion ammonium memiliki muatan positif (NH4+).
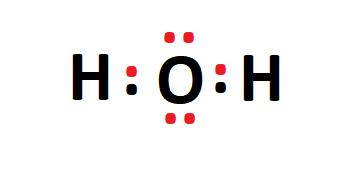
Gambar 1: Struktur Lewis dari Molekul Air (H2O)
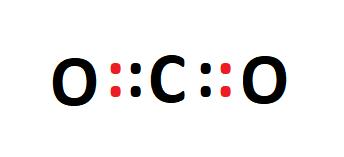
Gambar 2: Struktur Lewis dari Molekul Karbon Dioksida (CO2)
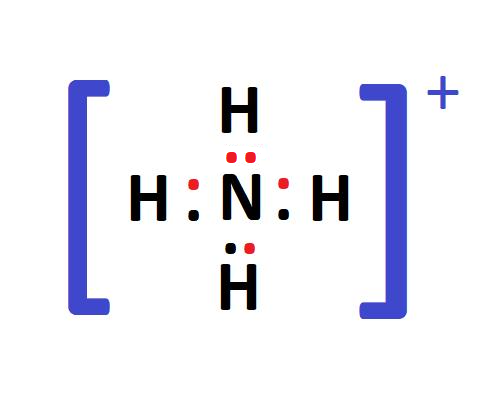
Gambar 3: Struktur Lewis dari Ion Ammonium (NH4+)